手性砜存在于许多药物和某些具有生物活性的天然产物中。由于砜基与羰基具有电子等排性,同时砜基团可以与生物靶标形成强氢键的能力使其用于提高药效和功效,因此手性砜已广泛用于现代药物化学中。目前烯手性烯丙基砜的合成主要通过钯、铱催化的烯丙基取代反应制备,或者通过联烯、1,3-二烯与硫醇化合物的氢硫醚化及后续氧化来合成。如何通过原子、步骤经济性的偶联反应,同时避免使用有毒及恶臭的低价硫试剂来制备手性烯丙基砜化合物仍旧是一个挑战(图1)。
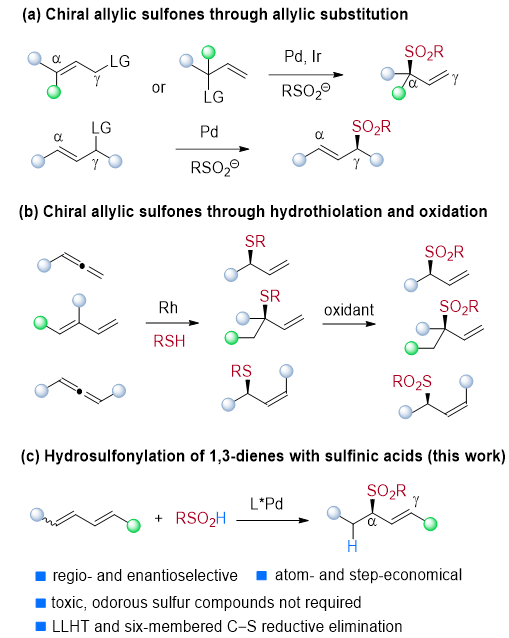
图1:手性烯丙基砜的合成
最近,资伟伟课题组报道了一种(R)-DTBM-Segphos / Pd催化的1,3-二烯与亚磺酸的区域选择性和对映选择性氢砜化的反应,该反应可实现原子经济和步骤经济性地合成1,3-二取代手性烯丙基砜化合物。该反应条件温和,并且具有广泛的底物适用性。
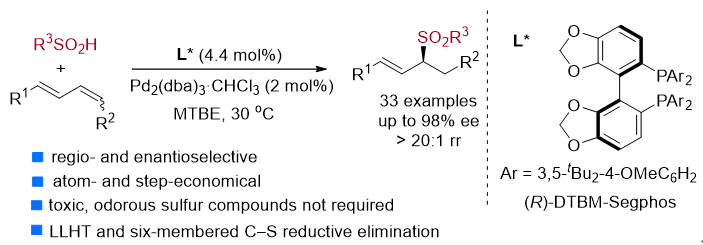
图2: 钯催化的1,3-的氢砜化反应制备手性烯丙基砜
结合实验和DTF计算研究表明,该反应并没有涉及到PdH物种参与的转化。而是通过配体到配体的氢转移(LLHT)引发,随后经历六元过渡态的C-S键还原消除来实现。计算中发现LLHT是该反应对映选择性的控制步骤,无论是 (Z,E)-还是 (E,E)-构型的1,3-二烯在LLHT步骤中形成目标产物(S)-3aa过渡态能量均低于形成(R)-3aa产物的过渡态能量。同时作者进一步分析过渡态的结构发现,底物的烯烃C-H与(R)-DTBM-Segphos的叔丁基之间的立体排斥是手性控制的关键因素(图3)。
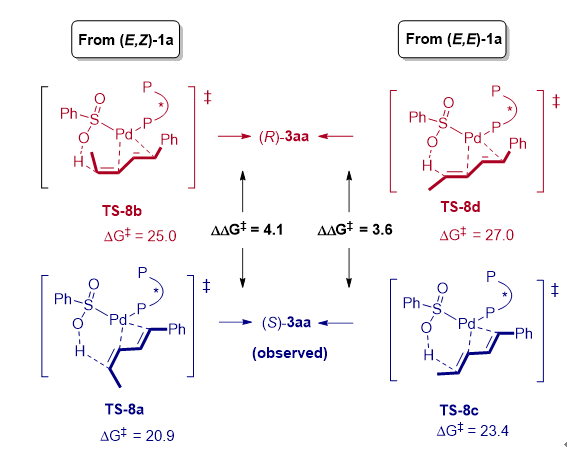
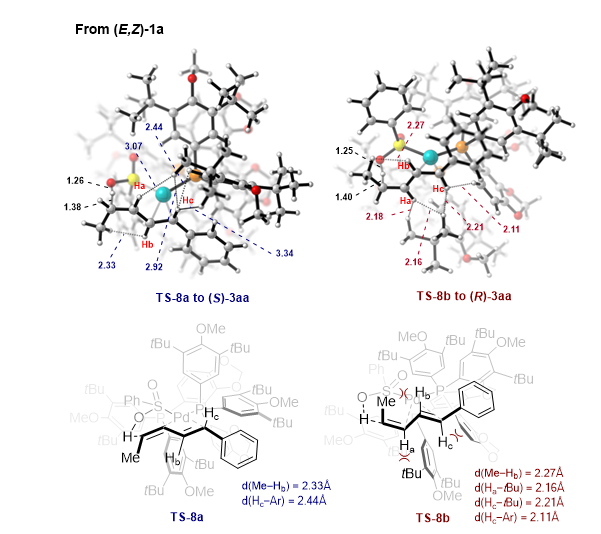
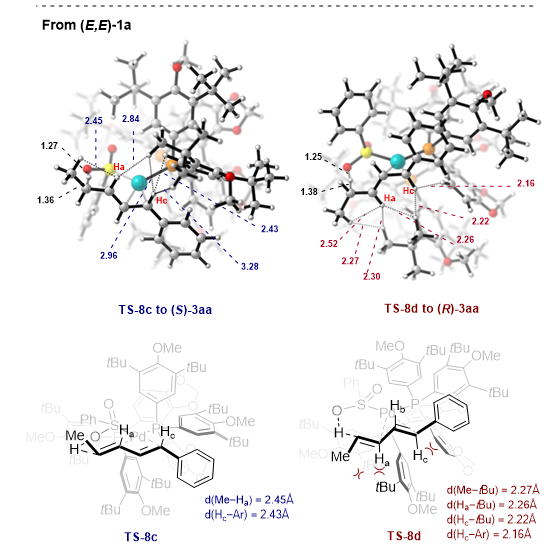
图3:DFT计算对立体选择性的解释
该研究成果以全文的方式发表在J. Am. Chem. Soc. 2020, 142, 15860-15869。课题组博士后张庆龙为本文的第一作者。